糖尿病被认为是当前增长速度最快的全球性健康挑战之一。根据国际糖尿病联合会的数据,预计到2045年,全球糖尿病患者人数将增至7.83亿。其中,2型糖尿病(T2DM)约占全部病例的90%以上。T2DM的核心病理特征是由胰腺β细胞功能障碍引起的胰岛素分泌不足。然而,目前多数治疗药物并不直接作用于β细胞,因而在延缓疾病进展方面疗效有限。肠促胰岛素激素GLP-1和GIP因具备促进胰岛素分泌的能力,为T2DM治疗策略的创新提供了新思路。在健康个体中,GLP-1和GIP均可有效刺激胰岛素释放,但单独应用GIP的治疗效果尚存在争议。相较而言,GLP-1受体(GLP1R)已成为T2DM治疗中最具潜力的靶点之一,其相关药物相比传统的胰岛素和磺脲类药物,具有更低的低血糖风险[1]。
除了GLP1R,研究还发现,其他代谢调节靶点如GIP受体(GIPR)、胰高血糖素受体(GCGR)以及成纤维细胞生长因子19和21(FGF19/21)在血糖控制和体重管理方面同样发挥着关键作用,为T2DM的治疗提供了更多可能。
近岸蛋白提供人源/鼠源/猴源及生物素化的GLP-1R、GIPR、GCGR、FGF-19/21等热门靶点蛋白,覆盖代谢疾病、糖尿病、肥胖症等研究领域!
高纯度、高活性,严格质控,确保实验可靠性
配套过表达细胞株,即拿即用,加速药物筛选与功能研究
支持定制服务(不同物种、标签、修饰等),满足个性化需求
GLP1R简介
G蛋白偶联受体(GPCRs)是目前药物研发中最重要的靶点家族之一,广泛分布于人体各类组织中,调控多种生理功能。GLP-1受体(GLP1R)正是其中一员,其内源性激动剂GLP-1具备促胰岛素分泌、抑制食欲、促进减重等多重作用,成为2型糖尿病(T2DM)治疗的重要突破口。
不过,天然GLP-1在体内极易被二肽基肽酶-4(DPP-4)迅速降解,半衰期仅约2分钟,限制了其临床应用。为此,研究者开发了DPP-4抑制剂和GLP-1类似物,延长其作用时间并取得良好临床效果。其中,GLP1R激动剂不仅降糖效果显著,还具有较低的低血糖风险和心血管获益,越来越受到关注[1]。
GLP1R激活后主要通过Gαs蛋白启动腺苷酸环化酶(AC),导致细胞内cAMP水平升高,进而激活蛋白激酶A(PKA)和Epac-2。这两条通路会协同关闭KATP和KV通道,引起细胞膜去极化,打开电压依赖性钙通道(VDCC),促进钙离子内流,最终触发胰岛素颗粒释放。
不仅如此,cAMP还可通过CREB途径上调胰岛素受体底物2(IRS2),增强β细胞生存能力。GLP1R还可通过Gαq介导磷脂酶C(PLC)和PKC信号,以及招募β-arrestin调节受体内化和脱敏。多通路协同作用,共同实现降糖、保β细胞、调能量代谢的多重效果[1]。
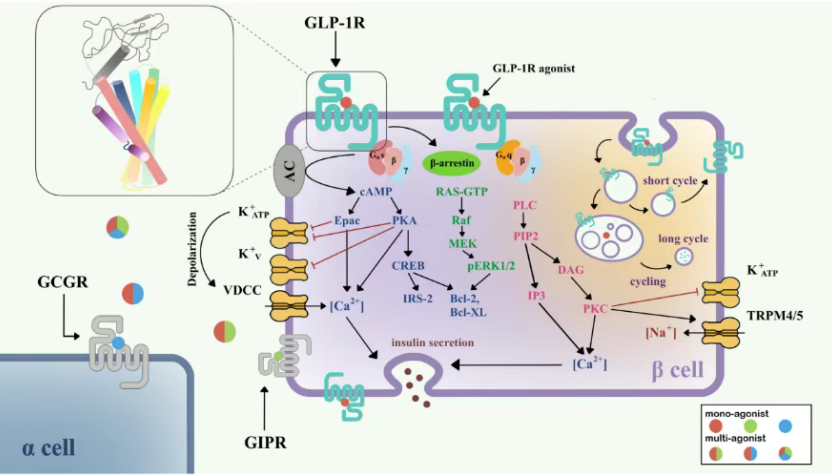
图1.GLP1R在胰岛β细胞中的信号通路[1]
胰高血糖素样肽-1受体(GLP1R)是2型糖尿病(T2DM)的关键治疗靶点。许多靶向GLP1R的药物已经进入临床治疗。然而,对副作用小、疗效高的新型功能分子的需求仍然很大。
GIPR简介
胃抑制肽受体(GIPR)是G蛋白偶联受体家族成员,具有典型的七跨膜结构,是GIP(葡萄糖依赖性促胰岛素多肽)的主要作用受体。GIP与GIPR结合后可调控能量代谢、增强肠促胰素效应,并在胰岛素分泌、血糖平衡及脂质代谢中发挥关键作用,被认为是维持代谢稳态的重要一环。GLP-1受体激动剂(GLP1RA)已广泛应用于2型糖尿病(T2DM)和肥胖治疗,且对部分心肾疾病患者也展现了潜在益处。然而,仍有不少患者未能达到理想的血糖与体重控制目标。这促使研究者探索更具协同作用的靶点,GIPR再次进入视野。新一代T2DM药物设计正朝着单分子双重激动剂方向发展,既激活GLP1R,也靶向GIPR,旨在进一步增强疗效、减少副作用。研究表明,联合激动这两种受体可放大cAMP信号,提升胰岛素释放,同时带来体重减轻效果,尤其对肥胖型糖尿病患者效果显著[2]。
Lu等人的研究表明,双特异性激动剂可在小鼠和猴子中显著降低体重与改善代谢参数。机制显示,这些分子能与GIPR和GLP1R同时结合并触发受体内化,在共表达两种受体的细胞中大幅放大cAMP通路活性[3]。
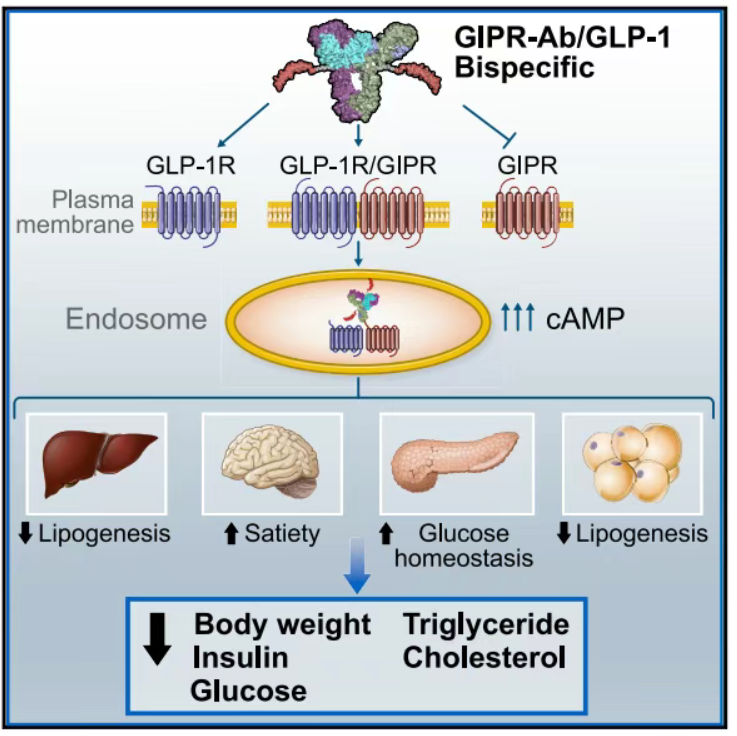
图2. 双特异性分子对抗/激活GIPR/GLP1R通路[3]
GCGR简介
胰高血糖素是一种由胰岛α细胞分泌的29肽激素,主要作用于肝脏,促进糖原分解与糖异生,从而升高血糖。其主要受体GCGR(胰高血糖素受体)是一种G蛋白偶联受体(GPCR),主要表达于肝细胞和胰岛β细胞。
胰高血糖素可与β细胞上的GCGR和GLP1R结合,激活Gαs蛋白,启动腺苷酸环化酶(AC),促进cAMP合成。高cAMP水平激活PKA,进一步促进胰岛素释放。葡萄糖通过GLUT2进入细胞后,引发ATP水平升高,增加胞内Ca²⁺浓度,共同增强胰岛素分泌[4]。
尽管胰高血糖素本质上是升糖因子,但针对GCGR的“逆向干预”已成为T1D和T2D治疗的探索方向。小分子拮抗剂、单克隆抗体(mAb)、以及反义寡核苷酸(ASO)等形式的GCGR抑制剂,均展现出通过降低胰高血糖素作用来控制血糖的潜力。
其中,REMD-477是一种GCGR完全竞争性抗体,在T1D患者中可显著减少胰岛素需求、改善血糖控制,且未观察到严重不良反应。另一款抗体REGN1193安全性良好,但部分受试者出现短暂转氨酶升高,提示仍需关注肝脏相关副作用[4]。
GCGR拮抗剂作为独立或联合治疗的新策略,正在被越来越多的临床研究验证,或将为糖尿病治疗提供更多可能。
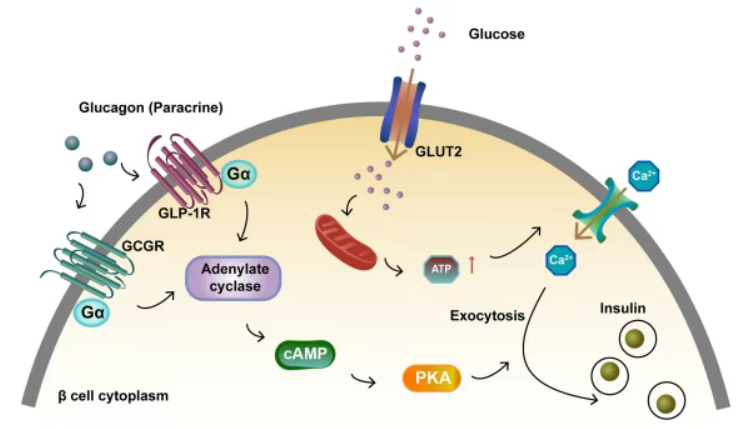
图3. 激活GCGR和GLP1R促进胰岛β细胞胰岛素分泌[4]
目前,GCGR拮抗剂正被探索用于T1D和T2D治疗,形式包括小分子、单克隆抗体和反义寡核苷酸,机制为抑制胰高血糖素作用以降糖。其中,REMD-477(完全竞争性抗体)在T1D患者中可显著减少胰岛素用量并改善血糖,无严重不良反应;REGN119安全性良好,偶见转氨酶短暂升高。整体来看,GCGR抗体类药物在血糖控制方面展现出良好前景[4]。
FGF-19/21简介
FGF21最早于2005年被发现具有降糖活性,可通过促进脂肪细胞摄糖来调节代谢[5]。尽管其主要来源是肝脏,但脂肪组织、胰岛和骨骼肌等也表达FGF21[6–7]。2018年,贾伟平团队发现,FGF21在能量过剩时可通过促进皮下脂肪增生,维持胰岛素敏感性和糖代谢稳态[8]。
在FGF家族中,FGF1、FGF4(经典型)与FGF19、FGF21(内分泌型)共同参与能量代谢调控。多项临床前研究表明,FGF19/21在治疗肥胖、糖尿病、高脂血症及NASH等方面具有显著潜力。目前,已有多种工程化的FGF类似物进入临床试验阶段[9]。
临床研究进展
当前,GLP-1R仍是最成熟的降糖减重药物靶点,已有14款相关药物成功上市,4款在报产中。2024年就有3款新药上市,而2025年1月和3月,广州银诺的依苏帕格鲁肽α(Efsubaglutide Alfa)和珠海联邦的利拉鲁肽注射液也先后获批。
目前研发热度依旧高涨,其中:
•III期临床:28款
•II期临床:15款
•I期临床:30款
•临床前阶段:4款
目前产品类型主要集中于重组多肽和生物类似药。与此同时,GIPR、GCGR、FGF19/21等新兴靶点也正逐步推进临床,虽多处于早期阶段,但多靶点联合或串联激动剂的策略正带来新的突破口,下一代代谢类药物值得期待。
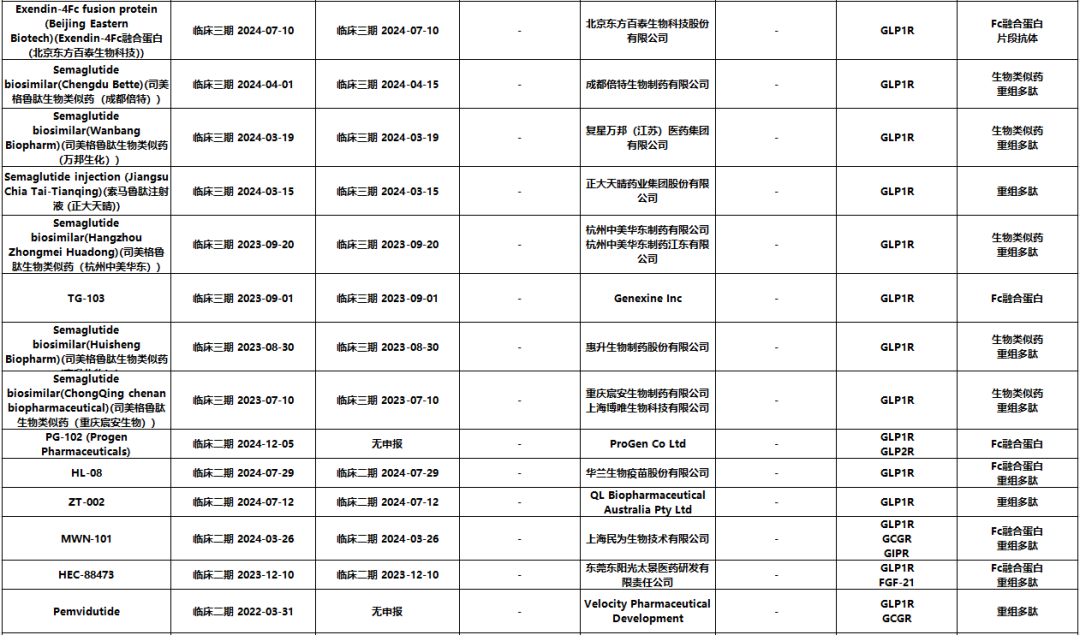
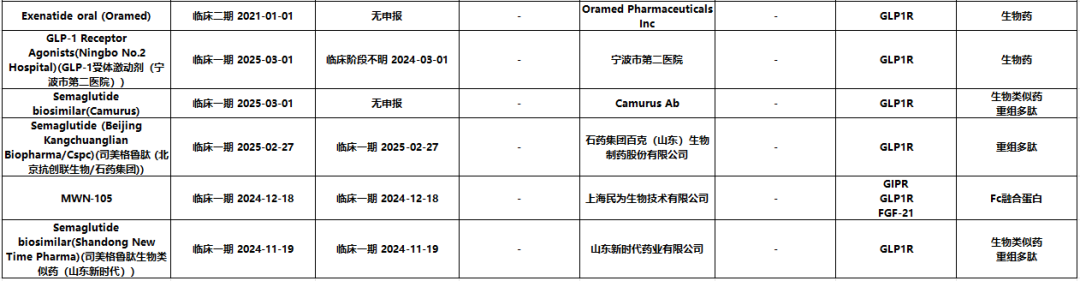
图4. GLP-1R/GLP2R/GCGR/GIRP/FGF-21靶点
临床进展(来源药渡)
部分数据展示
经过SEC-HPLC验证:
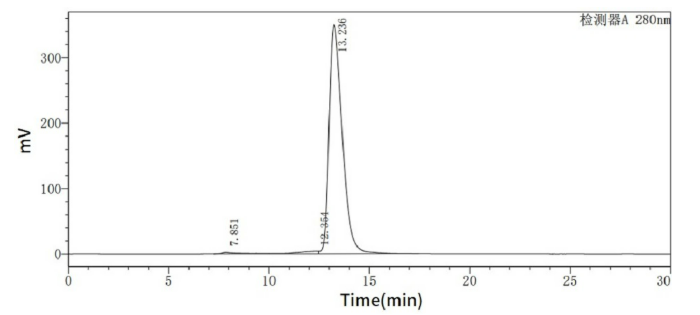
Greater than 95% as determined by SEC-HPLC.(Cat#C28P, QC verified)
经过ELISA验证:
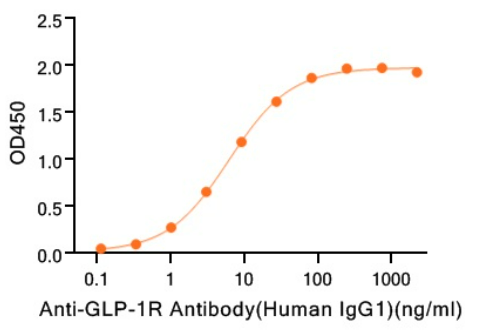
Immobilized Recombinant Human GLP-1R (C-Fc) (Cat#CU74) at 5 μg/ml (100 μl/well) can bind Anti-GLP-1R Antibody (Human IgG1). The ED50 of Anti-GLP-1R Antibody (Human IgG1) is 6.23 ng/ml.
经过BLI验证:
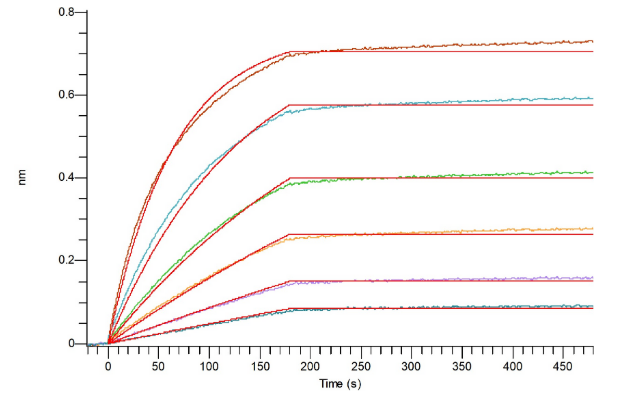
Loaded Recombinant Cynomolgus GLP1R N-ECD (C-6His) (Cat#C29S) on HIS1K Biosensor, can bind Anti-GLP-1R Antibody (Human IgG1) with an affinity constant of 2.45 pM as determined in BLI assay. (Regularly tested)
| Cat.No. | Product Name |
| CU74 | Recombinant Human GLP1R (Arg24-Tyr145) (C-Fc) |
| C29P | Recombinant Human GLP1R N-ECD (C-6His) |
| C29R | Recombinant Human GLP1R N-ECD (C-Fc) |
| C29S | Recombinant Cynomolgus GLP1R N-ECD (C-6His) |
| C28P | Recombinant Human GIPR N-ECD (C-6His) |
| C28R | Recombinant Human GIPR N-ECD (C-Fc) |
| CY126 | Biotinylated Human GIPR N-ECD (C-6His-Avi) |
| C29F | Recombinant Mouse GIPR N-ECD (C-Fc) |
| C29G | Recombinant Mouse GIPR N-ECD (C-Fc) |
| C29H | Recombinant Cynomolgus GIPR N-ECD (C-Fc) |
| C29K | Recombinant Human GCGR N-ECD (C-6His) |
| C29M | Recombinant Human GCGR N-ECD (C-Fc) |
| C30U | Recombinant Cynomolgus GCGR N-ECD (C-6His) |
| C30K | Recombinant Mouse GCGR N-ECD (C-6His) |
| CG74 | Recombinant Human FGF-19 (N-6His) |
| CY130 | Biotinylated Human GCGR N-ECD (C-6His-Avi) |
| C223 | Recombinant Human FGF-21 (N-6His) |
| NC119 | Recombinant Human FGF-21 (N-6His) |
| C04D | Recombinant Mouse FGF-21 (C-6His) |
| CS24 | Recombinant Cynomolgus FGF-21 (C-6His) |
| XCK44 | GCCR-CHO过表达细胞株 |
参考文献
[1] Wan W, Qin Q, Xie L, Zhang H, Wu F, Stevens RC, Liu Y. GLP-1R Signaling and Functional Molecules in Incretin Therapy. Molecules. 2023 Jan 11;28(2):751.
[2] Samms, Ricardo J et al. “GIPR Function in the Central Nervous System: Implications and Novel Perspectives for GIP-Based Therapies in Treating Metabolic Disorders.” Diabetes vol. 70,9 (2021): 1938-1944.
[3] Lu, Shu-Chen et al. “GIPR antagonist antibodies conjugated to GLP-1 peptide are bispecific molecules that decrease weight in obese mice and monkeys.” Cell reports. Medicine vol. 2,5 100263. 30 Apr. 2021.
[4] Jia Y, Liu Y, Feng L, Sun S, Sun G. Role of Glucagon and Its Receptor in the Pathogenesis of Diabetes. Front Endocrinol (Lausanne). 2022 Jun 16;13:928016.
[5] Kharitonenkov A, Shiyanova TL, Koester A, Ford AM, Micanovic R, Galbreath EJ, Sandusky GE, Hammond LJ, Moyers JS, Owens RA, Gromada J, Brozinick JT, Hawkins ED, Wroblewski VJ, Li DS, Mehrbod F, Jaskunas SR, Shanafelt AB. FGF-21 as a novel metabolic regulator. J Clin Invest. 2005 Jun;115(6):1627-35.
[6] Geng L, Lam KSL, Xu A. The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic. Nat Rev Endocrinol. 2020 Nov;16(11):654-667.
[7] Wente W, Efanov AM, Brenner M, Kharitonenkov A, Köster A, Sandusky GE, Sewing S, Treinies I, Zitzer H, Gromada J. Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signaling pathways. Diabetes. 2006 Sep;55(9):2470-8.
[8] Li, Huating , et al. "Fibroblast growth factor 21 increases insulin sensitivity through specific expansion of subcutaneous fat." Nature Communications 9.1(2018):272.
[9] Jin L, Yang R, Geng L, Xu A. Fibroblast Growth Factor-Based Pharmacotherapies for the Treatment of Obesity-Related Metabolic Complications. Annu Rev Pharmacol Toxicol. 2023 Jan 20;63:359-382.
